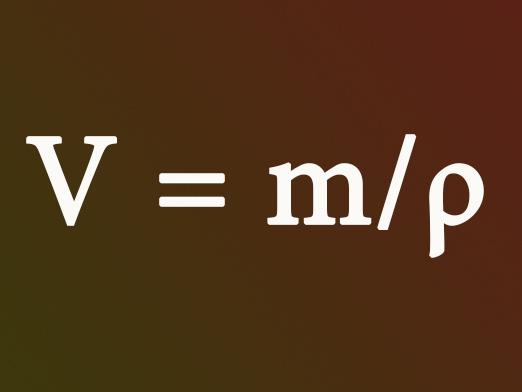كيفية العثور على حجم الغاز؟

قبل حل المشاكل، فمن الضروري النظر في الصيغ وقواعد كيفية العثور على حجم الغاز. ومن الجدير بالذكر قانون أفوغادرو. ويمكن حساب حجم الغاز نفسه بمساعدة العديد من الصيغ، واختيار منها واحدة مناسبة. عند اختيار الصيغة اللازمة، والظروف البيئية، وخاصة درجة الحرارة والضغط، ذات أهمية كبيرة.
قانون أفوغادرو
وتقول أنه في نفس الضغط وفإن نفس درجة الحرارة، في نفس أحجام الغازات المختلفة، تحتوي على نفس العدد من الجزيئات. عدد جزيئات الغاز الواردة في واحد الخلد هو عدد أفوغادرو. من هذا القانون فإنه يلي: 1 كمول من الغاز المثالي، وأي واحد، في نفس الضغط ودرجة الحرارة (760 ملم زئبق و t = 0 * C) تحتل دائما حجم واحد = 22،4136 M3.
كيفية تحديد حجم الغاز
- الصيغة V = n * فم غالبا ما توجد فيمشاكل. هنا حجم الغاز في لتر هو V، فم هو حجم المولي الغاز (لتر / مول)، والتي في ظل الظروف العادية هو 22.4 لتر / مول، و هو كمية المادة في الشامات. عندما لا يكون هناك قدر من المادة في الظروف، ولكن هناك كتلة من المسألة، ثم نمضي على النحو التالي: ن = م / م. هنا، M هو g / مول (الكتلة المولية للمادة)، وكتلة المادة في غرام هو م. في الجدول الدوري، هو مكتوب تحت كل عنصر، كتلك الذرية. نضيف كل الجماهير والحصول على واحد المطلوبة.
- لذلك، وكيفية حساب حجم الغاز. تلك المهمة في حمض الهيدروكلوريك بحل 10 غرام من الألمنيوم. السؤال: كم الهيدروجين يمكن أن تنطلق عند n. ذ.؟ رد فعل المعادلة على النحو التالي: 2AL + 6HCl (سبر) = 2AlCl3 + 3H2. في البداية، نجد الألومنيوم (عدد) وكان رد فعل وفقا للمعادلة: ن (آل) = م (آل) / M (آل). يتم أخذ وزن الألمنيوم (الرحى) من الجدول الدوري M (آل) = 27G و/ مول. استبدال: ن (آل) = 10/27 = 0،37mol. من المعادلة الكيميائية واضحة، وتشكل 3 مولات الهيدروجين عن طريق إذابة 2 مول من الألمنيوم. ينبغي أن يحسب عليه، وكم الهيدروجين يتم تمييز مع 0.4 مول من الألومنيوم: ن (H2) = 3 * 0.37 / 2 = 0،56mol. استبدال البيانات الصيغة وتحديد حجم الغاز. V = ن * VM = 0،56 * 22،4 = 12،54l.
اقرأ المزيد: